美国上市新药
近期一条来自海外监管的消息,让不少移植科医生和患者家庭都眼前一亮——美国食品药品监督管理局(FDA)批准YARTEMLEA(通用名:narsoplimab-wuug),用于治疗造血干细胞移植相关血栓性微血管病,覆盖成人及两岁及以上儿童。这也是首个美国批准的造血干细胞移植相关血栓性微血管病治疗药物。
年末的医药圈,像一座灯火通明的港口:一年里造出来的“新船”,终于要排队靠岸了。对患者和家属来说,关心的问题常常只有两个——今年到底来了多少新药?抗癌药占了多少?
对正在与HER2阳性晚期/转移性乳腺癌抗争的患者来说:一个真实、扎实、足够振奋人心的消息来了!据路透社报道,当地时间12月15日,美国食药监局(FDA)正式批准:Enhertu(德曲妥珠单抗,T-DXd)+ Perjeta(帕妥珠单抗),用于一线治疗HER2阳性的不可切除或转移性乳腺癌成人患者。
12月1日,美国专业肿瘤媒体Targeted Oncology发布了一份月度盘点,内容是:2025年11月美国药监局(FDA)在肿瘤领域的一系列审批,包括有哪些新药上场、哪些旧药扩展了用法、哪些检测和仿制药能帮忙降成本提效率等。
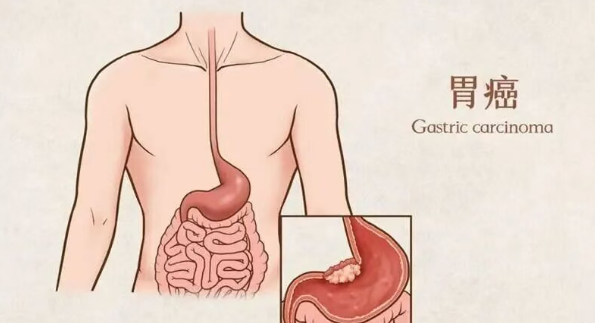
对很多中国家庭来说,胃癌两个字就像一块石头,砸下来,全家都跟着往下沉。即便做了大手术、咬牙挺过化疗,很多患者仍面临一个可怕的问题——复发:好不容易清掉的肿瘤,又悄悄长回来了。
美国时间2025年11月19日,肺癌领域传来两条重磅好消息:小细胞肺癌新药Imdelltra(tarlatamab):被美国药监局(FDA)从2024年的“加速批准”升级为“完全批准”。原因是:通过大型三期临床试验验证,在复发小细胞肺癌患者中,让死亡风险降低约40%。非小细胞肺癌新口服靶向药Hyrnuo(sevabertinib):被美国FDA批准上市,用于既往已接受系统治疗、携带HER2激活突变的晚期非鳞状非小细胞肺癌患者;临床研究中患者肿瘤明显缩小的比例约71%。同一天,两款面向不同肺癌人群的新药传来利好,对全球肺癌患者,尤其是已经进入“后线治疗”的患者来说,都是非常值得关注的希望信号。
这两天,血液肿瘤圈传来一个真正值得高亮的大消息:美国FDA正式批准口服menin抑制剂——Komzifti上市,用于治疗携带NPM1突变的、复发或难治性急性髓系白血病(AML)成人患者。这对很多已经走到“没什么办法了”的白血病家庭来说,又多出一种选择。
11月6日,美国药监局(FDA)宣布批准达雷妥尤单抗与透明质酸酶复方皮下制剂(Darzalex Faspro),用于高风险潜伏期多发性骨髓瘤(SMM)的成人患者——这是SMM历史上第一款被监管写进说明书的治疗药物。从过去只能“盯着看”,到今天,一条全新的时间线被改写了。
10月28日,美国癌症研究协会(AACR)发布一份《2025癌症进展报告》执行摘要,其关键信息指出:从2024年7月1日到2025年6月30日,美国食药监局(FDA)共批准了20个全新的抗肿瘤治疗,以及8个既有药物的新增适应证。截至2025年1月1日,美国境内“癌症幸存者”规模约1860万,且仍在增长,到2035年预计将超2200万。
10月24日,美国食药监局(FDA)正式批准瑞维美尼(Revuforj)上市,用于治疗复发或难治性NPM1突变型急性髓系白血病(AML)1岁及以上、无其他理想方案的成人和儿童患者。
 红杉资本(中国)被投企业
红杉资本(中国)被投企业

















 咨询医学顾问——免费获取全球医疗评估方案!
咨询医学顾问——免费获取全球医疗评估方案!
 提交成功!
提交成功!


 出国看病费用评估
出国看病费用评估