很多癌症的发生与不良生活方式有或多或少的、直接或间接的关系,比如吸烟、酗酒、缺乏运动和久坐、不良饮食习惯、熬夜、焦虑等。
几乎所有的病人都是疯狂的求生者,活着对他们来说,是某种特别的使命,也是一种下意识的进攻。活着,活着,他们都是对于生命真实的追求者与探测者。
鼓励国内居民到国外看病就诊与老百姓的健康息息相关,扩大这类进口,可以使国内老百姓享受到更好的医疗服务。
近日,据港媒报道:继去年10月自曝患乳腺癌接受手术后,女歌手李乐诗再次登上采访节目,透露了自己术后康复的情况。
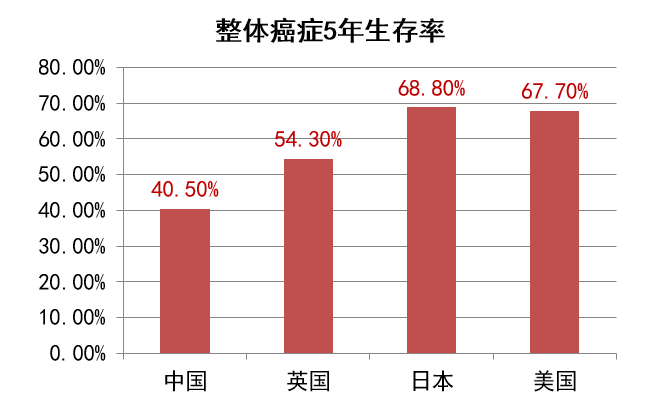
目前,癌症已经被全球医学界定义为一种慢性病,只要接受规范的治疗,很多早期癌症可以治愈,晚期癌症也有治愈可能,或者可以很好地控制,长期带瘤生存。
“我去过欧洲,但从来没有来过美国,没想到美国看病是这个样子的……”对于年近六十的高桥来说,这趟赴美给了他太多“意外”。自从今年4月查出肺癌,并且已经双肺转移,他的生活只剩下两个字:抗癌
首届消博会上,记者就国外企业如何开拓中国市场等问题采访了盛诺一家副总经理兼品牌市场中心总监方芳。
根据FIDES-01二期临床试验的中期分析结果显示,Derazantinib在FGFR2基因融合的晚期或不可手术肝内胆管癌患者中,显示出了良好的疾病控制率。
近日,loncastuximabtesirine-lpyl(Zynlonta)获美国食品药品监督管理局(FDA)加速批准,用于治疗经过二线或以上全身治疗的复发性或难治性大B细胞淋巴瘤成人患者,包括未特指的弥漫性大B细胞淋巴瘤、低级别淋巴瘤引起的弥漫性大B细胞淋巴瘤、高级别B细胞淋巴瘤。
肺癌是癌症死亡的常见原因,约占所有肿瘤相关死亡的三分之一。肺腺癌是一种非小细胞肺癌(NSCLC),约占肺癌诊断的40%,但这种疾病的治疗方法却很少。
 红杉资本(中国)被投企业
红杉资本(中国)被投企业









 咨询医学顾问——免费获取全球医疗评估方案!
咨询医学顾问——免费获取全球医疗评估方案!
 提交成功!
提交成功!


 出国看病费用评估
出国看病费用评估