美国国家综合癌症网络(NCCN)于2025年11月6日发布了新版《非小细胞肺癌临床实践指南》。新版与旧版相比,主要变化是新增了Dato-DXd,将其列为EGFR突变型非小细胞肺癌(NSCLC)患者在一线治疗失败后的首选方案。
英国每年约有5.5万名男性被诊断为前列腺癌。一旦患者对激素治疗产生耐药,目前有效的治疗方案十分有限,预后普遍不佳,因此科学家们正在积极寻找新的治疗路径。
有些肺癌患者在接受靶向药治疗时,最初效果很好,但癌细胞随后却“死灰复燃”,重新开始生长。美国耶鲁大学的研究人员最近揭示了一种分子层面的耐药机制,这种变化在用药后短短6-8周内就会出现。相关研究成果已于10月23日发表在《自然结构与分子生物学》杂志上。
根据在2025年欧洲肿瘤内科学会(ESMO)大会上公布的1b期Beamion LUNG-1临床试验的数据:前沿药Zongertinib在未接受过治疗的HER2(ERBB2)突变型晚期非小细胞肺癌(NSCLC)患者中,取得了非常积极的疗效。
2025年11月6日,美国食品药品监督管理局(FDA)批准皮下注射型Darzalex Faspro,用于治疗高危隐匿性多发性骨髓瘤(SMM)成年患者。
英国癌症研究所(ICR)的科学家在2025年欧洲肿瘤内科学会(ESMO)大会上公布的1b/2期Orig-AMI 4临床试验的结果显示:前沿药Amivantamab在晚期头颈癌患者中,展现出积极的疗效。76%的患者从治疗中获得获益——肿瘤缩小或停止生长。
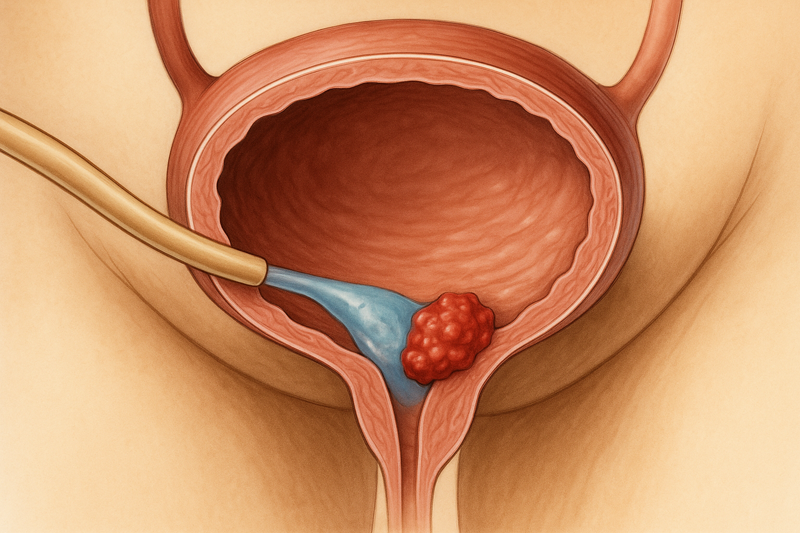
3期UTOPIA试验(试验编号NCT06331299)的初步结果显示:UGN-103(丝裂霉素膀胱内灌注液)在治疗复发性低级别、中等风险非肌层浸润性膀胱癌(NMIBC)患者时,表现出很高的完全缓解率(CR)。
嵌合抗原受体T细胞疗法(CAR-T疗法)已经彻底改变了癌症治疗的格局,但到目前为止,它的成功主要集中在血液系统恶性肿瘤(如白血病和淋巴瘤)上。
近日,美国的科学家发现了一种全新的杀死癌细胞的方法——通过消除癌细胞清理“垃圾”的能力,让它们最终被垃圾淹没并被“毒死”。
一项开创性的临床试验首次证明:将两种现有疗法联合使用,有望改善四肢局部晚期肉瘤和黑色素瘤患者的治疗效果。
 红杉资本(中国)被投企业
红杉资本(中国)被投企业







 咨询医学顾问——免费获取全球医疗评估方案!
咨询医学顾问——免费获取全球医疗评估方案!
 提交成功!
提交成功!


 出国看病费用评估
出国看病费用评估