PNAS:探究“最致命”肺癌,科学家发现CRISPR-Cas9系统新应用
时间:2020-01-08 作者:盛诺一家
以下文章来源于生物探索 ,作者王芳
生物探索
探索生物科技价值的新媒体
小细胞肺癌(SCLC)是一种极易复发、恶性程度极高的神经内分泌肿瘤,在肺癌中占比约为15%~20%。由于确诊时肿瘤很可能已经广泛扩散,因此小细胞肺癌往往很难治愈。尽管大规模测序研究已经在人体SCLC肿瘤中发现了许多反复突变的基因,但我们对于它们的功能仍然知之甚少。
然而,这一局面或许将在不久之后被打破。麻省理工学院的一支研究团队将CRISPR-Cas9系统应用于小细胞肺癌中靶基因突变的研究,并借助这一系统发现基因p107在SCLC中起着抑癌基因的作用,p107与其近亲p130的丧失导致明显的肿瘤表型。

https://doi.org/10.1073/pnas.1821893117
p107和p130是视网膜母细胞瘤蛋白家族的成员,二者都在大约6%的人类SCLC肿瘤中反复突变。研究人员将CRISPR-Cas9系统改编为成熟的SCLC小鼠模型,通过模拟Trp53 / Rb1中p107和p130缺失对该方法在SCLC中的可行性进行了验证。在肿瘤发生5.5个月后,研究人员从感染动物的肿瘤中分离出基因组DNA,随后对相应的sgRNAs靶向的基因组位点进行有针对性的深度测序,发现检测到的绝大多数序列包含移码插入或缺失,每个肿瘤都有1-4个不同的突变等位基因,这验证了使用CRISPR-Cas9系统对SCLC中候选肿瘤抑制基因缺失进行建模的可行性,并证明p107与p130一样,都是SCLC中的功能性肿瘤抑制因子。
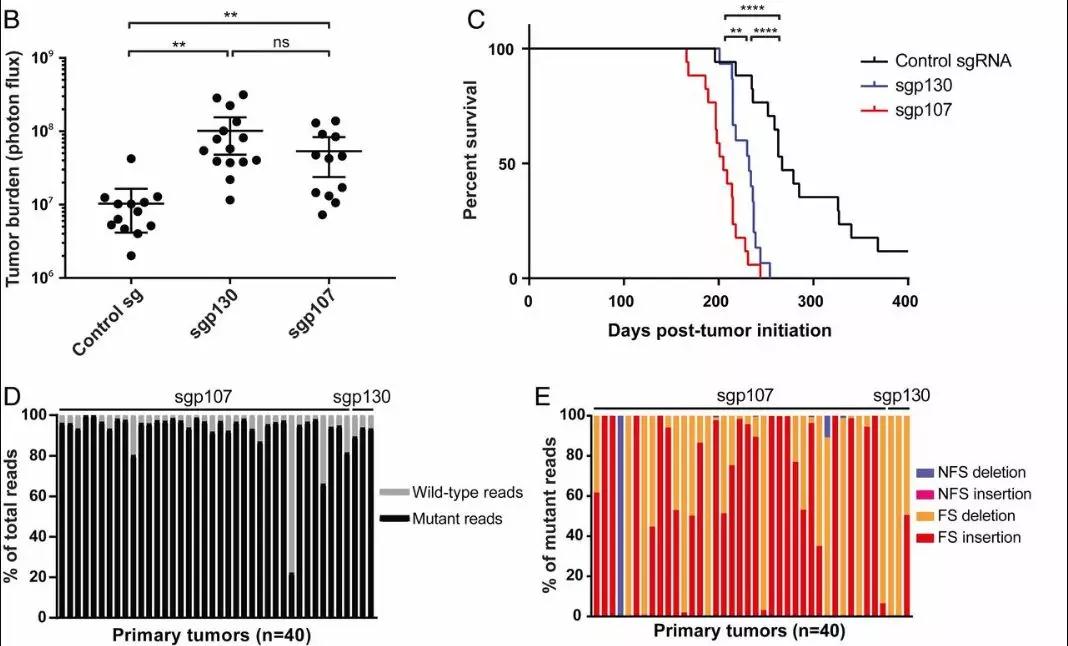
(p107的丢失会加速SCLC中的肿瘤进展)
在进一步的实验中,研究人员观察到,与sgp130感染的动物相比,sgp107感染的动物在癌症晚期还表现出更高的纵隔淋巴结转移发生率。与p130缺失相比,p107缺失导致肺内早期肿瘤病变分布的改变。随后,研究人员增加了磷酸化组蛋白H3(pHH3)染色测量,从而分析两组动物肿瘤中的增殖和凋亡率。结果显示来自sgp107感染动物的晚期肿瘤显示出更高的增殖率。有趣的是,在早期肿瘤中并未观察到这种差异。实验数据表明,与p130的丢失相比,p107的丢失对SCLC的发育有明显的影响。
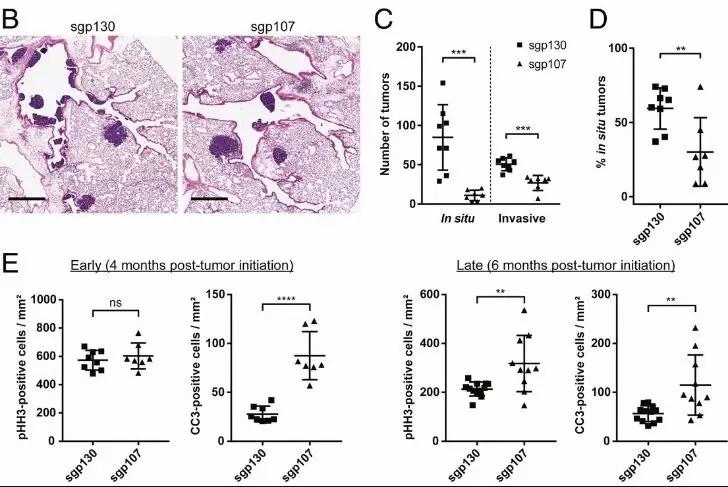
这项研究证明了使用CRISPR-Cas9系统在SCLC小鼠模型中模拟肿瘤抑制基因丢失的可行性,这为验证SCLC中频繁突变的其他候选基因的功能打开了大门,也将有助于验证未来SCLC的治疗靶点。
End
参考资料:
[1] CRISPR-mediated modeling and functional validation of candidate tumor suppressor genes in small cell lung cancer
【盛诺一家】成立于2011年,是国内领先的海外医疗服务咨询机构,与全球近50家权威医院签署正式官方合约,其中包括:
- ★美国梅奥诊所 (Mayo Clinic) — 2014年与盛诺一家官方签约

- ★美国波士顿儿童医院 — 2016年与盛诺一家官方签约

- ★美国克利夫兰医学中心 — 2016年与盛诺一家官方签约

- ★英国皇家马斯登癌症中心 — 2017年与盛诺一家官方签约

- 更多医院合作协议详见 → 盛诺一家医院合作资质列表
👉如果您或者家人需要快速前往海外医院就医,欢迎拨打免费咨询电话 400-875-6700,或通过 盛诺一家官网 预约咨询!
本文为出国看病科普文章,内容仅供阅读参考,不作为任何疾病治疗的指导意见。文章由盛诺一家编译,版权归盛诺一家公司所有,转载或引用本网内容须注明"转自盛诺一家官网(www.stluciabj.cn)"字样。
 红杉资本(中国)被投企业
红杉资本(中国)被投企业














 咨询医学顾问——免费获取全球医疗评估方案!
咨询医学顾问——免费获取全球医疗评估方案!
 提交成功!
提交成功!


 出国看病费用评估
出国看病费用评估