降低50%复发或死亡风险!罗氏乳腺癌新药获突破性疗法认定
时间:2019-02-14 作者:盛诺一家
本篇所有文字及图片数据均来自1. 瑞士罗氏公司于2019年2月5日发表的《罗氏公司向美国食品药品监督管理局递交关于Kadcyla的补充生物制剂许可申请,作为HER2阳性早期乳腺癌患者,新辅助治疗后,残余病灶的辅助治疗》 2. 新英格兰医学杂志于2018年12月5日发表的《曲妥珠单抗治疗残余浸润性HER2阳性乳腺癌》 3. 靶向肿瘤学于2019年2月5日发表于《向美国食品药品监督管理局递交关于T-MD1的批准申请,作为高危HER2阳性乳腺癌的辅助治疗》 4. Onclive于2018年12月5日发表的《T-DM1很可能为高危HER2阳性乳腺癌的标准新辅助治疗》 5. NCCN乳腺癌治疗指南 6. 美国癌症研究发表的《癌症统计资料:女性乳腺癌》,原始数据请见文末链接。
乳腺癌患者中,约有10-25%为HER2阳性,这类患者的癌细胞恶性程度高、病情进展快、并且更易复发和远处转移。
对于乳腺癌患者而言,肿瘤一旦复发转移,患者的生存时间将大大缩短。一般来说,早期乳腺癌患者的5年生存率可以接近,但一旦发生远处转移,5年生存率只有27%。
那么,究竟该使用怎样的方法才能有效预防乳腺癌复发,尽可能延长患者生存呢?
目前,美国综合癌症网络(NCCN)指南和中国乳腺癌临床实践指南都推荐曲妥珠单抗作为HER2阳性乳腺癌患者术后的辅助治疗。
但我们要说的这款药物Kadcyla(trastuzumab emtansine,T-DM1),比使用曲妥珠单抗后的复发或死亡风险还要低50%,可谓是青出于蓝而胜于蓝。
Kadcyla是何方神圣?
Kadcyla是罗氏研发的乳腺癌抗体药物偶联物,一头为靶向HER2的曲妥珠单抗,另一头是强效化疗药DM1,因此,也常被称为“T-DM1”。
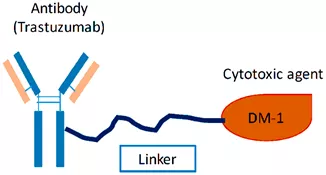
一头是曲妥珠单抗,一头是强效化疗药DM1
当DM1与曲妥珠单抗相连后,单抗可以把化疗药地带到肿瘤身边。
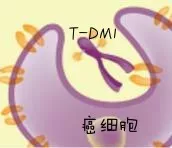
下面是该药物的一个作用机制图谱:
1.靶向HER2受体,抑制癌细胞增长,并激活免疫系统

2.进入癌细胞体内,发动内部攻击
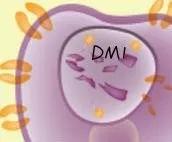
3.在癌细胞内部释放强效化疗药
4.化疗药发挥作用,杀死癌细胞
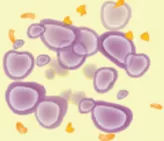
这样一来,不仅可以起到非常好的抗癌效果,而且理论上对正常组织的副作用也可以大幅降低。
其实,T-DM1并不算严格意义上的新药,早在2013年,美国FDA已批准该药物用于晚期HER2阳性乳腺癌患者。只是由于该药物还没有在国内上市,所以很多患者可能还比较陌生。
预防乳腺癌复发显奇效
降低50%复发/死亡风险
虽然T-DM1获批用于晚期乳腺癌,但它可不仅仅只针对晚期人群。
近日,罗氏已宣布向FDA递交关于T-DM1的补充生物制剂许可申请,作为HER2阳性早期乳腺癌患者,新辅助治疗后,残余病灶的辅助治疗。
这次申请主要是基于一项名为KATHERINE的 3期多中心临床研究,目的是为了评估T-DM1与曲妥珠单抗,作为辅助治疗在HER2阳性早期乳腺癌患者中的疗效和安全性。
该研究共纳入了1486名HER2阳性的早期乳腺癌患者。这些患者在术前均接受了新辅助化疗;并且术中发现乳腺或腋窝淋巴结中仍伴有残余的肿瘤病灶。在手术治疗后,患者被随机分为两组,分别接受T-DM1或曲妥珠单抗的辅助治疗。
结果显示,在接受治疗3年之后,T-DM1组有88.3%的患者乳腺癌没有复发,而曲妥珠单抗组仅为77.0%。另外,T-DM1组有89.7%的患者没有出现远处复发,而曲妥珠单抗组仅为83%。
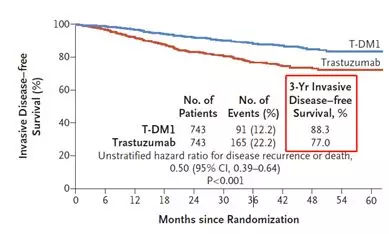
T-DM1与曲妥珠单抗无病生存率对比
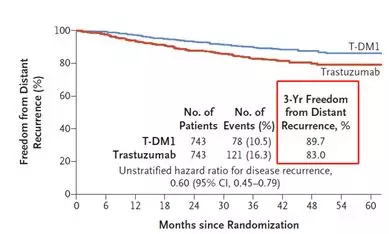
T-DM1与曲妥珠单抗无远处复发率对比
图片来自:N Engl J Med.
不仅如此,该研究还发现,与曲妥珠单抗相比,T-DM1能将患者侵袭性乳腺癌的复发和全因死亡风险降低50%。
可见,T-DM1在预防乳腺癌复发方面明显要更胜一筹。
多项措施并进
审评速度加快

近日,在罗氏递交T-DM1补充生物制剂许可申请的同时,FDA还授予了该药物突破性疗法的认定,用于HER2阳性早期乳腺癌患者的辅助治疗。
更值得一提的是,FDA还将启动实时肿瘤审评对这一申请进行评估。
这些措施都有望大幅度加快这一申请的审评速度。
罗氏首席医学官兼全球产品开发负责人Sandra Horning博士还为此表示:“Kadcyla获得了突破性疗法认定,并且是罗氏旗下头个使用FDA实时肿瘤审评试点项目的药物,这些FDA的举措都旨在加快审评速度,将药物尽快送到患者的手中,我们正在与FDA紧密合作,尽早将Kadcyla带给这些患者。”
参考链接:
瑞士罗氏公司于2019年2月5日发表的《罗氏公司向美国食品药品监督管理局递交关于Kadcyla的补充生物制剂许可申请,作为HER2阳性早期乳腺癌患者,新辅助治疗后,残余病灶的辅助治疗》https://www.roche.com/investors/updates/inv-update-2019-02-05.htmhttps://www.roche.com/investors/updates/inv-update-2019-02-05.htm
新英格兰医学杂志于2018年12月5日发表的《曲妥珠单抗治疗残余浸润性HER2阳性乳腺癌》
靶向肿瘤学于2019年2月5日发表于《向美国食品药品监督管理局递交关于T-MD1的批准申请,作为高危HER2阳性乳腺癌的辅助治疗》https://www.targetedonc.com/news/adjuvant-tdm1-submitted-for-fda-approval-in-highrisk-her2-breast-cancer/
Onclive于2018年12月5日发表的《T-DM1很可能为高危HER2阳性乳腺癌的标准新辅助治疗》https://www.onclive.com/conference-coverage/sabcs-2018/tdm1-likely-new-adjuvant-standard-in-highrisk-her2-breast-cancer
NCCN乳腺癌治疗指南https://www.nccn.org/professionals/physician_gls/pdf/breast.pdf
美国癌症研究发表的《癌症统计资料:女性乳腺癌》https://seer.cancer.gov/statfacts/html/breast.html
【盛诺一家】 成立于2011年,是国内权威的海外医疗咨询服务机构,提供出国看病、全球专家远程咨询、日本体检等服务。
海外医疗为什么首选盛诺一家?
- 稳健运营
深耕行业15年:实缴注册资本3,970万元,获红杉资本、中信里昂、腾讯等多轮注资。 - 权威认证
全球医疗资源:与美国MD安德森、梅奥诊所、麻省总医院、日本癌研有明医院等官方直签合作。
官方认证 合规运营:唯一同时获日本MEJ AMTAC资质与外务省“身元保证机构”授权的中国机构。 - 专业服务
专业可靠:服务团队成员70%拥有医学背景,包括医学院博士、三甲医院医生、资深医学翻译。
智能匹配:自主研发专利“全球医疗资源匹配模型”,精准推荐医院与医生。
全流程个体化服务:从病历翻译、签证辅助、就医预约到境外陪同、生活支持全面覆盖。
全球服务网络:在中、美、英、日等地设有15个全资分公司与服务中心,提供落地保障。 - 客户至上
提供5%-40%医疗费用专属折扣,签约48小时可全额退款,出具风险告知,倡导理性就医。 - 良好口碑
合作企业:为华为、中国人寿、民生银行等知名企业提供海外医疗咨询服务。
媒体报道:多次获人民日报、CCTV、新华社报道,被人民网评为“出国看病机构第一名”。
客户信赖:盛诺一家已服务近10000+重症患者家庭,60%客户通过老客户推荐,满意度高达99%。
👉 如果您或家人面临重大疾病决策,想了解海外就医方案?
✅ 请拨打免费咨询热线
400-875-6700,或通过
官方网站
预约咨询医学顾问,获取专业建议,开启全球精准医疗之路。
本文为海外就医科普文章,内容仅供阅读参考,不作为任何疾病治疗的指导意见。文章由盛诺一家编译,版权归盛诺一家公司所有,转载或引用本网内容须注明"转自盛诺一家官网(www.stluciabj.cn)"字样。
 红杉资本(中国)被投企业
红杉资本(中国)被投企业














 咨询医学顾问——免费获取全球医疗评估方案!
咨询医学顾问——免费获取全球医疗评估方案!
 提交成功!
提交成功!


 出国看病费用评估
出国看病费用评估